如何简单区分无机物与有机物?常见区分方法及实例解析
作者:佚名 来源:未知 时间:2024-10-26
在化学的广阔领域中,无机物与有机物的区分是一个基础而重要的概念,它不仅帮助科学家更好地理解和分类自然界的物质,还深刻影响着我们的日常生活、工业生产乃至科学研究的方方面面。本文将围绕“怎么区分无机物和有机物”这一主题,深入浅出地探讨两者之间的本质区别,以及在实际应用中如何准确判断。
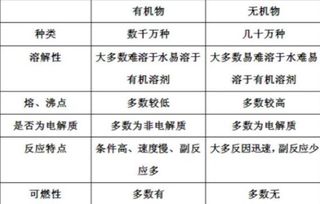
一、定义与基本概念
无机物
无机物,简而言之,是指通常不含有碳氢化合物(烃类)或其衍生物,或者虽然含有碳但性质与有机物截然不同的化合物。无机物广泛存在于自然界中,如水、盐类(如氯化钠NaCl)、氧化物(如二氧化碳CO₂)、酸碱、金属及非金属单质等。它们的性质多由离子键、共价键(非碳氢键)或金属键等构成,表现出较为稳定的物理化学性质。

有机物
有机物则是含碳化合物(一氧化碳、二氧化碳、碳酸盐、金属碳化物、氰化物除外)或碳氢化合物及其衍生物的总称。有机物是生命体的基础物质,如蛋白质、糖类、脂肪、核酸等,都是复杂的有机物。有机物的分子结构复杂多变,常含有碳碳键、碳氢键以及碳与其他元素的键合,这些特性赋予了有机物独特的物理化学性质,如溶解性、挥发性、反应活性等。
二、区分方法
尽管无机物与有机物在定义上有所区别,但在实际操作中,特别是在面对复杂化合物时,直接通过定义判断可能并不直观。因此,我们可以从以下几个方面入手进行区分:
1. 碳的存在形式与性质
最直接的方法是观察化合物中碳的存在形式。有机物通常含有碳-碳键或碳-氢键,形成复杂的链状、环状或支链结构。而无机物中的碳,如果存在,往往是以简单的离子或共价键形式与其他元素结合,如碳酸盐中的碳。
2. 物理性质
溶解性:有机物一般难溶于水而易溶于有机溶剂(如酒精、苯、氯仿等),这是由于其分子间的相互作用力与水分子间的氢键作用力差异所致。相比之下,无机物在水中的溶解度则依其性质而异,如盐类多易溶于水。
挥发性:有机物一般具有较高的挥发性,尤其在常温下,而多数无机物则不易挥发。
熔点与沸点:有机物的熔点与沸点相对较低,且随着分子量的增大而升高。无机物的熔点与沸点则因物质类型而异,部分无机盐类也有较高的熔点。
3. 化学性质
反应活性:有机物通常具有丰富的化学反应性,能够参与多种类型的化学反应,如加成、取代、消去、氧化、还原等。无机物虽然也能参与化学反应,但其反应类型相对有限,且往往与离子键的断裂与形成有关。
燃烧性:有机物大多能够燃烧,燃烧时一般伴有火焰和烟的产生,这是因为有机物中含有碳、氢等可燃元素。无机物中,除了少数可燃金属(如镁)外,大多不具备燃烧性。
4. 特殊测试
在某些情况下,还可以利用特定的化学反应或测试手段来区分无机物与有机物。例如,利用红外光谱、核磁共振等现代分析技术,可以直接分析化合物的分子结构,从而明确其属于有机物还是无机物。
三、实例分析
以乙酸(CH₃COOH)和碳酸氢钠(NaHCO₃)为例进行说明:
乙酸:作为一种羧酸,乙酸含有碳-碳键和碳-氢键,是典型的有机物。它易溶于水和多种有机溶剂,具有较高的挥发性和可燃性,能参与多种化学反应,如酯化反应、酸碱中和反应等。
碳酸氢钠:虽然碳酸氢钠的分子式中含有碳元素,但其化学性质和物理性质更接近于无机物。它是强碱弱酸盐,易溶于水,水溶液呈碱性,不易挥发,也不具备可燃性。在化学反应中,它主要通过离子键的断裂与形成参与反应,如与酸反应生成二氧化碳和水。
四、结语
综上所述,无机物与有机物的区分并非绝对,但在大多数情况下,我们可以通过观察碳的存在形式、物理性质、化学性质以及利用特殊测试手段来进行判断。掌握这些区分方法,不仅有助于我们更好地理解化学世界的多样性,还能在实际应用中提高物质识别的准确性和效率。在探索化学奥秘的征途中,这一基础知识的掌握无疑将为我们打开一扇通往更广阔世界的大门。






























