初三化学必备:元素周期表高清图解
作者:佚名 来源:未知 时间:2024-11-19
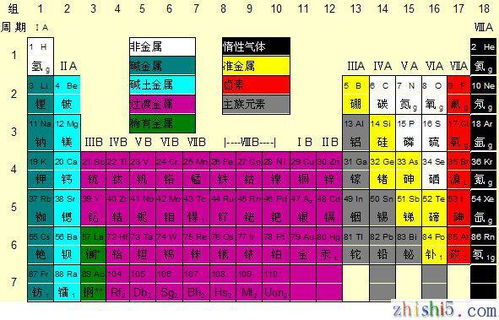
在化学学习的旅程中,元素周期表无疑是一座指引方向的灯塔。对于初三的同学们而言,这张表不仅是化学学习的基础,更是打开物质世界奥秘之门的钥匙。今天,我们就来一起深入探索初三化学元素周期表图,了解它的构成、特点、规律以及应用,帮助大家更好地掌握这一重要工具。
一、元素周期表的基本构成
元素周期表是一张以元素序数(即质子数)为序,将元素按照一定规律排列成行和列的表格。这张表共有18列、7行(包括镧系和锕系),每一行被称为一个周期,每一列被称为一个族。在周期表中,元素按照原子序数由小到大依次排列,从左上角的氢元素开始,到右下角的铀元素结束(初三阶段通常只学到20号元素左右)。
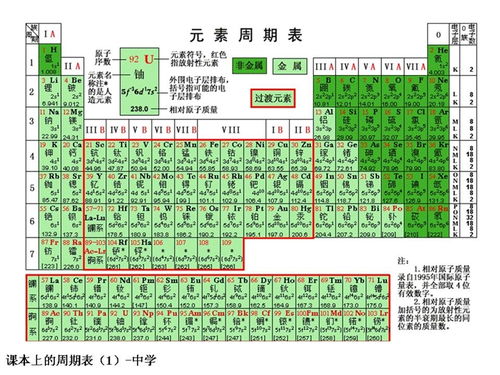
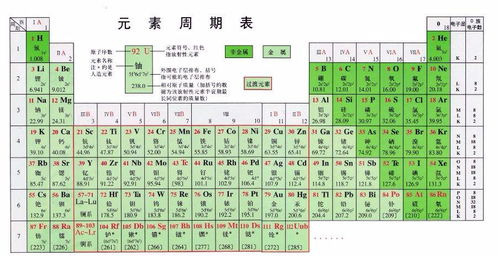
二、元素周期表的特点与规律
1. 周期性规律
元素周期表的最大特点就是其内在的周期性规律。在同一周期中,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强;元素的原子半径逐渐减小,核电荷数逐渐增加,导致元素对最外层电子的吸引力逐渐增强。在同一族中,从上到下,元素的金属性逐渐增强,非金属性逐渐减弱;元素的原子半径逐渐增大,对最外层电子的吸引力逐渐减弱。
2. 分区规律
元素周期表可以根据元素的性质被划分为不同的区域,如s区、p区、d区、f区等。这些区域的划分有助于我们更好地理解元素的性质及其变化规律。例如,s区和p区的元素主要是主族元素,它们的性质相对较为稳定;而d区和f区的元素则主要是过渡元素和稀土元素,它们的性质较为复杂多变。
3. 对角线关系
在元素周期表中,某些元素之间存在对角线关系。这些元素在周期表中的位置虽然不同,但它们的性质却有一定的相似性。例如,锂和镁、铍和铝等就存在对角线关系,它们的某些化学性质相似。
三、元素周期表的解读与应用
1. 预测元素性质
元素周期表是预测元素性质的重要工具。通过查看元素在周期表中的位置,我们可以大致推断出它的金属性、非金属性、原子半径、电离能、电负性等性质。这对于我们理解元素的化学行为以及进行化学反应的预测具有重要意义。
2. 指导化学反应
元素周期表还可以指导我们进行化学反应的分析和预测。例如,根据元素在周期表中的位置,我们可以判断它是否容易与其他元素发生氧化还原反应、置换反应等。这对于我们进行化学实验设计和化学方程式的书写具有指导意义。
3. 理解物质结构
元素周期表与物质结构紧密相关。通过了解元素在周期表中的位置及其性质变化规律,我们可以更好地理解物质的组成、结构和性质之间的关系。这对于我们学习化学键、分子结构、晶体结构等化学知识具有重要意义。
4. 推动科学研究
元素周期表在科学研究中也发挥着重要作用。科学家们通过研究元素周期表的规律性和异常性,不断发现新元素、新性质和新规律,推动化学科学的发展。同时,元素周期表也是材料科学、生命科学、环境科学等领域研究的重要基础。
四、初三化学元素周期表图的具体解读
对于初三的同学们而言,掌握元素周期表的前20号元素是基本要求。这些元素包括氢(H)、氦(He)、锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)、氖(Ne)、钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)、钾(K)和钙(Ca)。
在这些元素中,氢和氦位于周期表的第一周期,它们是最轻的元素,也是宇宙中含量最丰富的元素。锂到氖这七种元素位于第二周期,它们都是非金属元素(除了锂和铍外),具有较为稳定的性质。钠到氩这八种元素位于第三周期,它们包括了金属元素、非金属元素和稀有气体元素。钾和钙则位于第四周期的开始部分,它们都是典型的金属元素。
在记忆这些元素时,同学们可以采用一些巧妙的方法。例如,可以将它们的名称或符号编成顺口溜或歌曲来帮助记忆;也可以利用元素周期表的规律性和特点来辅助记忆。例如,可以利用同一周期元素性质的递变性来推断未知元素的性质;可以利用同一族元素性质的相似性来归纳和总结已知元素的性质。
此外,同学们还可以结合化学实验来加深对元素周期表的理解。例如,可以通过观察不同元素与氧气、水等物质的反应情况来比较它们的金属性和非金属性;可以通过测量不同元素的原子半径、电离能等物理量来验证元素周期表的规律性。
五、结语
元素周期表是化学学习中的一把利剑,它能够帮助我们更好地理解物质的本质和变化规律。对于初三的同学们而言,掌握元素周期表的基本构成、特点与规律以及解读与应用方法是非常重要的。通过不断学习和实践,我们可以逐步提高自己的化学素养和综合能力,为未来的学习和工作打下坚实的基础。希望本文能够帮助大家更好地认识和理解元素周期表,激发大家对化学学科的兴趣和热爱!
- 上一篇: 揭秘:苹果手机究竟支持哪些神秘视频格式?
- 下一篇: 优化电脑图标布局与任务栏配置指南






























