揭秘:电极电势如何影响氧化还原反应
作者:佚名 来源:未知 时间:2025-04-10
在化学领域中,电极电势与氧化还原反应之间存在着密切且复杂的关系。这种关系不仅揭示了化学反应的本质,还为我们预测和控制化学反应的方向提供了有力的工具。本文将从多个维度探讨电极电势与氧化还原反应的关系。
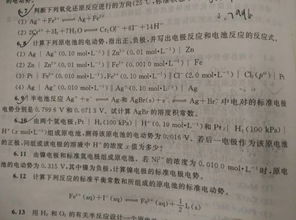
首先,我们需要明确几个基本概念。氧化还原反应是指在反应过程中,物质的氧化数(或化合价)发生变化的反应。这类反应的核心是电子的转移:一个物质失去电子,即被氧化;另一个物质获得电子,即被还原。氧化剂和还原剂是氧化还原反应中的两个关键角色。氧化剂是接受电子的物质,具有氧化性;还原剂是提供电子的物质,具有还原性。
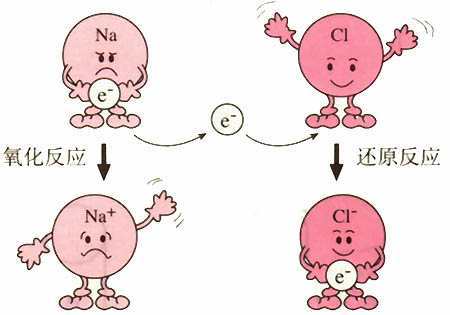
电极电势,则是描述电极上电子流动性质的物理量。它是通过测量电极与电解质溶液之间的电势差得到的。电极电势的大小取决于电极的本性,如电极材料的种类和状态,并受温度、介质和离子浓度等因素的影响。在电化学中,通常采用标准氢电极作为标准电极,其电极电势被定义为0V。其他电极的电极电势则是相对于标准氢电极来测量的。
电极电势与氧化还原反应方向的关系是本文的核心内容。从电化学的角度来看,氧化还原反应的方向是由电极电势决定的。具体来说,当氧化剂的电极电势大于还原剂的电极电势时,反应可以自发进行。这是因为,在这种情况下,电子从还原剂流向氧化剂,形成了从负极到正极的电流,从而驱动反应的进行。反之,如果还原剂的电极电势大于氧化剂的电极电势,则反应不能自发进行。此时,电子的流动方向与反应所需的方向相反,因此反应无法发生。
这种关系可以通过电极电势的数值来直观地理解。以标准电极电势为例,它是指在一定条件下(如标准状态、298K等),电极反应达到平衡时的电极电势。标准电极电势的数值越大,说明该电极的氧化型物质越容易得到电子,即氧化性越强;反之,数值越小,说明还原型物质越容易失去电子,即还原性越强。因此,我们可以通过比较不同物质的标准电极电势来预测它们之间的氧化还原反应能否发生以及反应的方向。
除了预测反应方向外,电极电势还可以用来判断氧化还原反应的进行程度。在电化学中,电池电动势是衡量氧化还原反应进行程度的重要指标。电池电动势越大,说明反应进行的程度越深;反之,电池电动势越小,说明反应进行的程度越浅。而电池电动势的大小与电极电势有直接关系:它等于正极电极电势减去负极电极电势。因此,我们可以通过测量电池电动势来间接了解氧化还原反应的进行程度。
此外,电极电势还与氧化还原反应的自由能变化有关。自由能是描述系统做功能力的物理量,在化学反应中,它反映了反应自发进行的趋势。根据热力学原理,当反应的自由能变化小于零时,反应可以自发进行;反之,则不能自发进行。而电极电势与自由能变化之间存在定量关系:电极电势越大,自由能变化越小;电极电势越小,自由能变化越大。这意味着,在氧化还原反应中,如果氧化剂的电极电势很高或还原剂的电极电势很低,则反应可能具有较高的自由能变化,从而自发进行的趋势更强。
值得注意的是,电极电势并不是一成不变的。它受到多种因素的影响,如温度、离子浓度、溶液的酸碱性等。这些因素的变化会导致电极电势的波动,从而影响氧化还原反应的方向和程度。因此,在实际应用中,我们需要根据具体的反应条件和实验数据来确定电极电势的数值,并据此预测和控制化学反应的进行。
从实际应用的角度来看,电极电势与氧化还原反应的关系在化学工业、环境监测、能源转换等领域具有广泛的应用价值。例如,在电镀、电解等电化学过程中,我们需要通过控制电极电势来调节反应速率和产物选择性;在环境监测中,我们可以利用电极电势来检测水体中的重金属离子等污染物;在能源转换方面,电极电势的研究有助于我们开发更高效、更环保的电池和燃料电池技术。
此外,电极电势与氧化还原反应的关系还为我们理解生命现象提供了重要的线索。生物体内的许多过程都涉及氧化还原反应,如呼吸作用、光合作用等。这些过程中的电子传递和能量转换都与电极电势密切相关。因此,通过研究电极电势与氧化还原反应的关系,我们可以更深入地了解生命现象的本质和机制。
综上所述,电极电势与氧化还原反应之间存在着密切且复杂的关系。这种关系不仅揭示了化学反应的本质和规律,还为我们预测和控制化学反应的方向提供了有力的工具。通过深入研究电极电势与氧化还原反应的关系,我们可以进一步拓展其在化学工业、环境监测、能源转换等领域的应用前景,并为推动科学技术的发展做出更大的贡献。
- 上一篇: DNF账号被封如何申请解封
- 下一篇: 如何申请微博免费微号





































